Химия 9 Габриелян Контрольная 1
Контрольная работа по химии № 1 для 9 класса по теме «Электролитическая диссоциация» по учебнику химии базового уровня Габриеляна, Остроумова и Сладкова. Цитаты из учебного пособия использованы в учебных целях. Код материалов: Химия 9 Габриелян Контрольная 1 (в 4-х вариантах). Ответов нет!
Вернуться к Списку контрольных (в ОГЛАВЛЕНИЕ)
Химия 9 класс (Габриелян)
Контрольная работа № 1
К-1 Вариант 1
Часть 1. Тестовые задания с выбором одного правильного ответа
№ 1. К неэлектролитам относят
1) оксид серы(IV); 2) гидроксид натрия; 3) хлорид бария; 4) азотную кислоту.
№ 2. Даны вещества
A) Н2SO4; Б) Са(ОН)2; B) Cu(ОН)2; Г) НСl; Д) Н2S
К слабым электролитам относят вещества
1) АД, 2) ВД, 3) БВ, 4) ВГД.
№ 3. Вещества, которые при диссоциации в водном растворе в качестве анионов образуют только гидроксид-ионы ОН–, относят
1) к кислотам, 2) к оксидам, 3) к щелочам, 4) к солям.
№ 4. Хлорид-ионы содержатся в растворе вещества, формула которого
1) КСlO3, 2) НСlO2, 3) HClO4, 4) НСl.
№ 5. Наибольшее число анионов образуется при полной диссоциации 1 моль вещества, формула которого
1) СаCl2, 2) CuSO4, 3) АlВг3, 4) Ba(NO3)2
№ 6. Реакция ионного обмена возможна между веществами, формулы которых
1) Н2SO4 и NaNO3, 2) Na2SO4 и НСl, 3) Al2(SO4)3 и ВаСl2, 4) KNO3 и CaSO4
№ 7. Сокращённое ионное уравнение Са2+ + СО32– = СаСO3↓ соответствует взаимодействию
1) соляной кислоты и карбоната кальция
2) хлорида кальция и карбоната калия
3) карбоната натрия и нитрата калия
4) нитрата кальция и углекислого газа.
№ 8. Одновременно не могут находиться в растворе ионы
1) К+ и ОН–, 2) H+ и SO42–, 3) Cu2+ и NO3–, 4) Ag+ и Cl–
№ 9. Верны ли следующие суждения о гид рол нас солей?
А. Все соли подвергаются гидролизу.
Б. Водные растворы солей могут иметь нейтральную, щелочную или кислотную среду.
1) верно только А
2) верно только Б
3) оба суждения верны
4) оба суждения неверны.
№ 10. Щелочную среду имеют водные растворы солей, формулы которых
1) (NH4)2S и NaBr
2) ВаСl2 и К2SO3
3) Na2CO3 и К2S
4) CuSO4 и LiNO3
Тестовые задания с выбором двух правильных ответов и на установление соответствии
№ 11. Газообразное вещество образуется при взаимодействии водных растворов веществ, формулы которых
1) Н2SO4 и LiOH
2) HNO3 и Na2SO3
3) NH4Cl и КОН
4) Ca(NO3)2 и FeCl2
5) К2СO3 и NaNO3
№ 12. Установите соответствие между реагентами и сокращённым ионным уравнением реакции, протекающей между ними.
РЕАГЕНТЫ: A) НCl + К2СO3 —>
Б) Ва(ОН)2 + Н2SO4 —>
B) ВаCl2 + Na2CO3 —>
СОКРАЩЁННОЕ ИОННОЕ УРАВНЕНИЕ:
1) Ва2+ + CO32– = ВаСO3
2) Ва2+ + SO42– = BaSO4
3) 2Н+ + СО32– = СO2↑ + Н2O
4) Н+ + ОН– = H2O
5) Ва2+ + 2OН– + 2Н+ + SO42– = BaSO4 + 2H2O
Часть 2. Задания с развёрнутым ответом
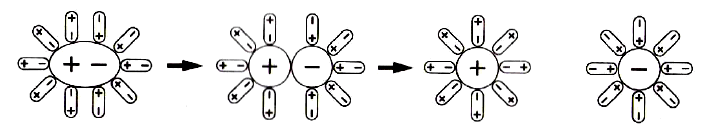
№ 13. Изучите рисунок и придумайте подрисуночную подпись.
№ 14. Углекислый газ не поддерживает горение. На этом основано действие углекислотных огнетушителей, которые применяют для тушения горящего электрооборудования, компьютерной техники, кинопроекционной аппаратуры, художественных ценностей в картинных галереях, музеях, экспозиционных залах и др. Углекислый газ можно получить при действии сильной кислоты на карбонат какого-либо металла. Напишите уравнение такой реакции в молекулярном и ионном виде.
К-1 Вариант 2
К-1 Вариант 3
К-1 Вариант 4
Ответов НЕТ !
Вы смотрели: Контрольная работа по химии № 1 для 9 класса по теме «Электролитическая диссоциация» по учебнику химии базового уровня Габриеляна, Остроумова и Сладкова. Цитаты из учебного пособия использованы в учебных целях. Код материалов: Химия 9 Габриелян Контрольная 1 (в 4-х вариантах).
Вернуться к Списку контрольных (в ОГЛАВЛЕНИЕ)


