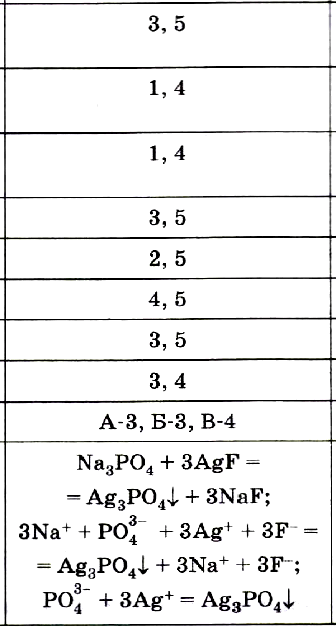Химия 9 Габриелян Проверочная 34
Химия 9 Габриелян Проверочная 34 «Диссоциация электролитов в водных растворах. Ионные уравнения реакций» с ответами по учебнику химии для 9 класса. Все работы представлены в 3 вариантах. Цитаты из учебного пособия использованы в учебных целях.
Вернуться к Списку работ (в ОГЛАВЛЕНИЕ)
Химия 9 класс (Габриелян)
Проверочная работа № 34
ПР-34. Вариант 1
№ 1. При испытании веществ на электропроводность лампочка прибора загорится, если погрузить электроды в
1) кристаллическую поваренную соль
2) кристаллический сахар
3) раствор сахара в воде
4) раствор поваренной соли в воде
5) расплав поваренной соли
ОТВЕТ: 4, 5.
№ 2. К сильным электролитам относят
1) все щёлочи
2) все растворимые кислоты
3) все оксиды
4) все растворимые вещества
5) все растворимые соли
ОТВЕТ: 1, 5.
№ 3. Слабые электролиты — это
1) гидроксид меди (II)
2) плавиковая кислота
3) гидроксид натрия
4) хлорид аммония,
5) сернистый газ
ОТВЕТ: 1, 2.
№ 4. Сильные кислоты — это
1) плавиковая, 2) азотная, 3) соляная, 4) сероводородная, 5) сернистая.
ОТВЕТ: 2, 3.
№ 5. Каких частиц больше других в растворе гидрокарбоната калия?
1) КНСO3, 2) K+, 3) Н+, 4) СО32–, 5) HCO32–.
ОТВЕТ: 2, 5.
№ 6. Наибольшее число ионов образуется в результате растворения в воде равных количеств
1) сернистой кислоты, 2) сульфита натрия, 3) гидросульфита натрия, 4) угольной кислоты, 5) карбоната натрия.
ОТВЕТ: 2, 5.
№ 7. Для осуществления реакции Fe2+ + 2OН– = Fe(OH)2 необходимы следующие вещества
1) карбонат железа (II)
2) гидроксид железа (II)
3) сульфат железа (II)
4) гидроксид натрия
5) гидроксид магния
ОТВЕТ: 3, 4.
№ 8. Сокращённому ионному уравнению H+ + OH– = H2O соответствует взаимодействие между
1) Mg(OH)2 и H2S
2) Mg(OH)2 и H2SO4
3) Ba(OH)2 и H2SO4
4) Ba(OH)2 и НСl
5) HNO3 и Ba(OH)2
ОТВЕТ: 4, 5.
№ 9. Установите соответствие взаимодействующими ионами и реагентами.
Взаимодействующие ионы:
A) SO42– + Ва2+
Б) 2OH– + Fe2+
B) 2H+ + SO32–
Реагенты:
1) гидроксид бария и серная кислота
2) гидроксид бария и нитрат железа (II)
3) сульфит натрия и серная кислота
4) нитрат бария и серная кислота
5) нитрат железа (II) и гидроксид магния
ОТВЕТ: А–4, Б–2, В–3.
№ 10. Приведите пример реакции, в результате которой образуется осадок голубого цвета, составив уравнения в молекулярной, ионной и сокращённой ионной формах.
ОТВЕТ: CuSO4 + 2NaOH = Cu(OH)2 + Na2SO4;
Cu2+ + SO42– + 2Na+ + 2OH– = Cu(OH)2↓ + 2Na+ + SO42–;
Cu2+ + 2OH– = Cu(OH)2↓
ПР-34. Вариант 2
ПР-34. Вариант 3
Дополнительные задания
№ 1. Установите соответствие между формулой газообразного вещества и средой его водного раствора.
Формула вещества: A) NH3, Б) СО2, B) SO2, Г) СО.
Среда раствора: 1) кислая, 2) нейтральная, 3) щелочная.
ОТВЕТ: А–3, Б–1, В–1, Г–2.
№ 2. Установите соответствие между формулой соли и типом гидролиза.
Формула соли: A) АlСl3, Б) (NH4)2SO3, B) (CH3COO)2Zn, Г) Na2CO3.
Тин гидролиза: 1) по катиону, 2) по аниону, 3) по катиону и аниону.
ОТВЕТ: А–1, Б–3, В–3, Г–2.
№ 3. Установите соответствие между формулой соли и средой её водного раствора.
Формула соли: A) K2SiO3, Б) СаСl2, B) Fe(NO3)2, Г) KNO3.
Среда: 1) кислая, 2) нейтральная, 3) щелочная.
ОТВЕТ: А–3, Б–2, В–1, Г–2.
Вы смотрели: Химия 9 Габриелян Проверочная 34 «Диссоциация электролитов в водных растворах. Ионные уравнения реакций» с ответами по учебнику химии для 9 класса. Цитаты из учебного пособия использованы в учебных целях.
Вернуться к Списку работ (в ОГЛАВЛЕНИЕ)